
In dieser Ausgabe unseres Faktenchecks beantworten wir Fragen aus dem Bereich der Medizin – also rund um Krankheiten, Medikamente und andere Therapien. Und wollen dabei auch erklären, was Tierversuche eigentlich damit zu tun haben (und was nicht).
Klickt auf eine der folgenden Aussagen, um mehr zu erfahren! Falls Ihr sie wieder zusammenklappen wollt, einfach nochmal darauf klicken.
"Obwohl viele Nobelpreise im Bereich Physiologie oder Medizin vergeben wurden, halten nur 45% der Preisträger Tierversuche für gerechtfertigt."
Diese Aussage suggeriert, dass 55% der Nobelpreisträger in Physiologie oder Medizin nichts von Tierversuchen halten. Das spiegelt jedoch nicht die Wahrheit wider.
Tatsächlich wurde diese Statistik ursprünglich von Andrew Blake erhoben, einem Mitglied der Gruppe Patients Voice for Medical Advance, welche die medizinische Forschung unterstützt: Andrew Blake schrieb alle 71 damals lebenden Nobelpreisträger für Physiologie oder Medizin an und fragte sie, ob sie Tierversuche für nötig erachteten. Von 71 Preisträgern antworteten 39. 32 von ihnen sagten , dass Tierversuche entscheidend für ihre eigene Forschung waren. Diese 32 entsprechen zwar tatsächlich 45% aller lebenden Nobelpreisträger, jedoch 82% der Teilnehmer an der Befragung! Zudem stimmten 100% der Teilnehmer zu, dass Tierversuche wichtig für die Entdeckung und Weiterentwicklung in der Physiologie und Medizin waren und immer noch sind. Die falsche Interpretation der Zahlen ist auf den Anti-Vivisektions-Newsletter (VIN Issue 2) zurückzuführen. Die Tatsache, dass mehr als die Hälfte der Nobelpreisträger auf den Fragebogen einer kleinen, relativ unbekannten Patientenvereinigung wie Patients Voice for Medical Advance antworteten, zeigt, wie wichtig sie das Thema Tierversuche nehmen.
Im Mai 2015 wandten sich 16 europäische Nobelpreisträger in einem offenen Brief an die europäische Kommission. Sie forderten diese eindringlich auf, sich für die Fortführung von Tierversuchen einzusetzen, solange sie nicht vollständig durch tierfreie Methoden ersetzt werden können.
"Bei Tiermodellen für Krankheiten wird vergessen, dass bei Menschen noch ganz andere Faktoren eine Rolle spielen, z.B. Ernährung und Stress."
Ein Tiermodell bildet nie die Gesamtheit einer Krankheit ab, immer nur einen Teil. Zur Erforschung eines komplexen Sachverhalts ist es oft hilfreich, einzelne Teilbereiche isoliert zu betrachten. Ein berühmtes Beispiel ist die Vererbungslehre. Erst als der Mönch und Wissenschaftler Gregor Mendel sich auf nur ein vererbtes Merkmal konzentrierte – die Farbe von Erbsen – konnte er die zugrundeliegenden Regeln erkennen.
Ein wertvolles Tiermodell für die Parkinson’sche Krankheit sind Affen, die mit MPTP behandelt werden. Dieses Nervengift zerstört selektiv einen bestimmten Zelltypen, die dopaminergen Nervenzellen. Die gleichen Zellen sterben aus unbekannten Gründen auch bei Parkinsonpatienten. Mit MPTP behandelte Affen sind natürlich kein Modell für die Entstehung von Parkinson. Patienten erkranken, ohne jemals mit MPTP in Kontakt gekommen zu sein. Sie sind aber ein sehr gutes Modell für die Folgen der Krankheit, die mit dem Fehlen der dopaminergen Nervenzellen einhergehen. Der Forschung an diesen Affen verdanken wir die tiefe Hirnstimulation des subthalamischen Nucleus. Diese Behandlung lindert viele Symptome der Parkinson’schen Krankheit und verbessert die Lebensqualität tausender Patienten alleine in Deutschland. Für diese Entwicklung wurde 2014 der Lasker-Preis für herausragende medizinische Errungenschaften verliehen.
Andere Tiermodelle sind ähnlich wertvoll für die Erforschung anderer Krankheiten. Besonders transgene Tiere sind für die Forschung unverzichtbar geworden, da man mit ihnen Erbkrankheiten wie etwa Huntington sehr präzise simulieren kann.
Auf Mausmodelle geht ein neuer Ansatz in der Krebstherapie zurück, die Krebsimmuntherapie. Das Krebsimmuntherapeutikum Nivolumab, das Ende 2014 in USA zur Behandlung von Hautkrebs und Anfang 2015 zur Behandlung von Lungenkrebs zugelassen wurde, wirkt, indem es einen Rezeptor namens PD-1 blockiert. Mithilfe genveränderter Mäuse wurde entdeckt, dass die Aktivierung von PD-1 durch den Liganden PD-L1 eine Immunantwort unterdrückt (1, 2). Als dann der Ligand PD-L1 auf menschlichen Krebszellen gefunden wurde (3, 4), konnte die Hypothese aufgestellt werden, dass Krebszellen diesen Mechanismus ausnutzen, um dem Immunsystem zu entkommen. In einem Mausmodell für Bauchspeicheldrüsenkrebs wurde diese Hypothese bestätigt: Wurde die Bindung von PD-L1 an PD-1 verhindert, wurde der Krebs vom Immunsystem angegriffen. Krebsimmuntherapie wurde 2013 vom Wissenschaftsmagazin Science zum Durchbruch des Jahres gewählt. Auch in dieser Forschung war es erfolgreich, sich mithilfe von Tiermodellen auf einen Aspekt einer komplexen Krankheit zu konzentrieren.
Es sollte jedoch betont werden, dass die Erforschung von komplexen Erkrankungen immer verschiedene Methoden beinhalten muss. Epidemiologische Untersuchungen an Menschen können z.B. Risikofaktoren wie bestimmte Gen-Polymorphismen oder Umweltfaktoren identifizieren. In Tiermodellen kann die Wirkung solcher Faktoren isoliert betrachtet werden. In vitro Methoden können helfen, die Mechanismen zu verstehen. Keine dieser Methoden kann durch die andere ersetzt werden.
"Am Fall Contergan sieht man, dass Medikamententests an Tieren nichts nützen."
In Wirklichkeit ist Contergan ein besonders eindringliches Beispiel für die Notwendigkeit von Medikamententests an Tieren. Der eigentliche Skandal der Tragödie war, dass Contergan für schwangere Frauen zugelassen wurde, ohne jemals an trächtigen Tieren getestet worden zu sein. Die Schädlichkeit von Contergan für die Embryonalentwicklung konnte man weder an erwachsenen Tieren sehen, noch an den erwachsenen Menschen, an denen es vor der Zulassung ebenfalls getestet wurde.
Auf der Suche nach dem Mechanismus der entwicklungsschädigenden Wirkung von Contergan ist der dramatische Effekt mittlerweile für mehrere Tierarten demonstriert worden, z.B. in Mäusen, Ratten, Hamstern, Kaninchen, Pavianen und Weißbüschelaffen. In Ratten und Mäusen ist der Schaden sogar so groß, dass die Föten absterben und vor der Geburt von der Mutter resorbiert werden, also gar nicht erst auf die Welt kommen. Wäre Contergan an schwangeren Tieren getestet worden, hätten die Missbildungen oder die reduzierte Zahl der Welpen zum Stopp der Zulassung geführt. Aus diesem Grund ist Contergan in den USA nie zugelassen worden. Die verantwortliche Behördenmitarbeiterin Frances Oldham Kelsey bestand unter anderem darauf, dass das Medikament zuerst an trächtigen Tieren getestet müsse. Die Notwendigkeit dazu hatte sie aus ihrer eigenen Forschung mit Kaninchen erkannt.
Heutzutage ist es gesetzlich vorgeschrieben, dass Medikamente für schwangere Frauen zuerst an schwangeren Tieren getestet werden müssen. Durch diese Regelung konnte bis heute verhindert werden, dass sich ein Fall wie der von Contergan wiederholt. Für diese Tests existiert weder heute noch in naher Zukunft eine tierfreie Alternative. Es existiert kein geeignetes in-vitro Modell für die menschliche Embryonalentwicklung, und da wir bis heute die schädliche Wirkung von Contergan nicht vollständig verstehen, wäre es auch nicht möglich, die Nebenwirkungen im Computermodell vorauszusagen.
"Viele segensreiche Arzneien wie Penicillin wären bei der heutigen Vorgehensweise (mit Tierversuchen) durchgefallen."
Diese Behauptung gibt es für verschiedene Medikamente. Weil die Entdeckung von Penicillin aber von besonders großer Bedeutung für die Medizin war, schauen wir uns dieses Beispiel mal ausführlicher an.
Dazu müssen wir zunächst die heutige Vorgehensweise bei der Wirkstofffindung betrachten. Es ist gesetzlich vorgeschrieben, dass potentielle neue Medikamente in Tierversuchen auf Toxizität getestet werden, bevor sie zum ersten Mal Menschen verabreicht werden (hierbei handelt es sich um ca. 20-80 freiwillige Versuchspersonen – wir sind zu diesem Zeitpunkt noch Jahre von einer möglichen Zulassung entfernt). In manchen Fällen kann es sein, dass eine Tierart eine giftige Substanz viel besser verträgt als der Mensch. Um das Risiko für die freiwilligen Versuchspersonen zu minimieren, muss daher die Toxizität in zwei verschiedenen Tierarten untersucht werden, die nicht nah miteinander verwandt sind. Meistens sind das Ratten und Schweine, manchmal auch Hunde oder Affen. Das Ziel der Toxizitätstests ist nicht, herauszufinden ob eine Substanz giftig ist. Jedes Medikament ist giftig, wenn die Dosis hoch genug ist. Das Ziel ist, herauszufinden welche Art von Problemen zu erwarten ist (z.B. Belastung der Leber oder Anreichung der Substanz im Körper) und ab welcher Dosis solche Probleme vermutlich auftreten werden. Wenn in diesen Tieren Nebenwirkungen auftreten, die nicht durch die erwartete Wirkung aufgewogen werden, wird der Wirkstoff hier aussortiert.
Penicillin wäre bei dieser Prozedur nicht durchgefallen. Das Gerücht kommt daher, dass Penicillin – genau wie andere Antibiotika – in hohen Dosen schädlich für Meerschweinchen und Hamster ist. In diesen Tieren wirkt es genau wie in allen anderen, Menschen eingeschlossen: Es tötet Bakterien ab. Genauer tötet Penicillin bevorzugt gram-positive Bakterien. Nun haben Meerschweinchen und Hamster die seltene Besonderheit, dass ihre Darmflora hauptsächlich aus gram-positiven Bakterien besteht. Sterben die ab, wird der Darm von anderen Bakterien besiedelt, die bei den Tieren Entzündung und Durchfall verursachen, die schnell zum Tod führen können. Aus diesem Grund käme auch niemand auf die Idee, ein neues Antibiotikum an Hamstern testen zu wollen. Durch die Grundlagenforschung kennen wir viele derartige Besonderheiten in verschiedenen Tierarten. Dieses Wissen hilft uns, für wissenschaftliche Fragestellungen – und eben für Toxizitätstests – geeignete Tierarten auszuwählen.
Ohne Tierversuche hätten wir übrigens heute kein Penicillin. Florey und Chain schrieben 1940 mit einem Versuch an acht Mäusen Geschichte. Allen Mäusen wurde eine tödliche Dosis infektiöser Bakterien (Streptokokken) injiziert. Vier davon bekamen zusätzlich Penicillin. Diese vier überlebten. Diese Entdeckung gilt als eine der wichtigsten der Medizingeschichte. Sie hat Millionen von Menschen und Tieren das Leben gerettet, und tut es immer noch.
"Insulin verursacht angeborene Missbildungen bei Meerschweinchen, aber nicht beim Menschen."
Alle Säugetiere – Meerschweinchen eingeschlossen – produzieren Insulin. Eine zu hohe Verabreichung von Insulin in trächtigen Tieren schädigt den Fötus. Das liegt daran, dass Insulin den Blutzuckerspiegel senkt. Es ist davon auszugehen, dass die Verabreichung von Insulin in vergleichbarer Dosis an schwangere Frauen zu ähnlichen Schädigungen des Babys führen würde (dies zu testen wäre jedoch selbstverständlich ethisch nicht vertretbar).
Insulin verschiedener Arten ist sich so ähnlich, dass es zur Behandlung von Diabetikern jahrzehntelang aus Schweinen isoliert wurde.
Die Isolierung von Insulin und die Erkenntnis seiner lebensrettenden Wirkung gehen auf Tierversuche zurück. Banting und Mcleod erhielten 1923 dafür den Nobelpreis für Medizin. 1978 konnte Insulin durch den Einsatz von Gentechnik erstmals Mal synthetisch gewonnen werden. Heutzutage wird Insulin fast ausschließlich synthetisch hergestellt, ein Beispiel für den erfolgreichen Einsatz von Alternativmethoden.
"Aspirin ist giftig für Tiere, aber nicht für Menschen."
Giftigkeit von Aspirin wurde für Katzen und Ratten bei Dosen festgestellt, die etwa 40-50 Tabletten pro Tag in Menschen entsprechen (250-300 mg/kg). In dieser Dosis ist Aspirin für Menschen ebenfalls giftig. Gleiches gilt für die Schädlichkeit hoher Dosen während der Schwangerschaft. Glücklicherweise ist die wirksame Dosis von Aspirin um ein vielfaches geringer, so dass wir es als Medikament nutzen können.
Es wird verschiedentlich spekuliert, dass es heutzutage schwierig wäre, Aspirin als neues Medikament auf den Markt zu bringen. Das liegt aber wohlgemerkt an den sehr strengen heutigen Zulassungsbestimmungen – denn Aspirin kann, wie andere rezeptfreie Schmerzmittel, durchaus ernste Nebenwirkungen haben. Es liegt nicht etwa an einer irreführenden Giftigkeit des Medikaments für Tiere. Im Gegenteil ist Aspirin ein gängiges Medikament in der Tiermedizin. Wie für andere Medikamente unterscheidet sich natürlich die empfohlene Dosis zwischen Tierarten, weil viele Tiere Medikamente unterschiedlich schnell abbauen.
"Der Wirkstoff TGN1412 hatte bei Tieren keine Nebenwirkungen, menschliche Probanden starben jedoch fast."
2006 wurde im Londoner Northwick Park Hospital der monoklonale Antikörper TGN1412 in einer klinischen Studie erstmalig freiwilligen menschlichen Versuchsteilnehmern verabreicht. Kurz darauf setzte eine heftige Immunreaktion ein, die sechs Teilnehmer in Lebensgefahr brachte. Alle überlebten, doch ihr Immunsystem könnte langfristig beeinträchtig sein, und ein Mann verlor durch diesen Unfall Zehen und Fingerspitzen. Dieser Vorfall passierte trotz der vorgeschriebenen Toxizitätstest, die zuvor durchgeführt worden waren. Ist TGN1412 also ein Beweis dafür, dass Tierversuche ungeeignet sind, uns vor giftigen Substanzen zu schützen?
Alle neuen Medikamente werden zuerst wenigen meist gesunden Versuchspersonen verabreicht (Phase-1-Studie), bevor eine größere Gruppe von Patienten sie bekommen. Um diese Versuchspersonen bestmöglich vor Unfällen zu schützen, müssen wir für Toxizitätstests immer die aussagekräftigsten verfügbaren Methoden benutzen. Wie gut die heutigen Toxizitätstests sind, sieht man daran, wie selten Unfälle wie der mit TGN1412 passieren – bei etwa 200 derartiger Phase-1-Studien alleine in England pro Jahr. Wie ein Anschnallgurt oder ein Sicherheitsnetz können jedoch auch die besten Methoden keinen 100%igen Schutz bieten. TGN1412 wurde vor der Anwendung am Menschen sowohl an Tieren (Affen und Ratten) als auch in einer Zellkultur menschlicher Zellen getestet. Keines der drei Testsysteme deutete auf eine Schädlichkeit des Wirkstoffes hin. Die Zellkultur versagte in diesem Fall also ebenso wie der Test am Tier.
Durch genauere Erforschung der Mechanismen weiß man heute, warum es zu den heftigen Nebenwirkungen gekommen ist. TGN1412 aktiviert Zellen des Immunsystems (sog. regulatorische T-Zellen), die in der Lage sind, überschießende Entzündungen und Abwehrreaktionen abzubremsen. Daher war TGN1412 ein erfolgversprechender Kandidat zur Behandlung von Autoimmunerkrankungen wie Rheuma oder Multipler Sklerose. Außer den regulatorischen T-Zellen aktiviert TGN1412 in geringerem Maße auch einen weiteren Typ von T-Zellen, die entzündungfördernden Effektor-Gedächtniszellen. Effektor-Gedächtniszellen bilden sich im Laufe unseres Lebens mit jedem Krankheitserreger, dem wir ausgesetzt sind. Überaktivierung dieser Zellen löste bei den sechs Versuchsteilnehmern die gefährliche Immunreaktion aus.
Die Nagetiere, an denen getestet wurde, waren sehr sauber gehalten und so jung, dass sie praktisch keine entzündungsfördernden natürlichen Effektor-Gedächtniszellen hatten. TGN1412 aktivierte damit also nur die regulatorischen T-Zellen, während die Wirkung auf die entzündungsfördernden Effektor-Gedächtniszellen unentdeckt blieb.
Makaken, an denen das Präparat ebenfalls getestet wurde, haben zwar wie Menschen den Rezeptor, an den TGN1412 bindet. Sie tragen ihn aber nicht auf den Effektor-Gedächtniszellen. Daher führt TGN1412 in Makaken nicht zur Ausschüttung entzündungsfördernder Stoffe.
Der zusätzliche Test in Zellkultur erfolgte an Immunzellen, die aus menschlichem Blut isoliert worden waren. Später fand man heraus, dass die Zellen im Blutstrom in einen „Ruhezustand“ übergehen, da ihnen Signale fehlen, die sie nur im Gewebe erhalten. Damit reagierten sie nicht mehr auf Signale wie das von TGN1412. Durch dieses Wissen ist es mittlerweile gelungen, einen verbesserten in vitro Test zu entwickeln, der die Reaktion der T-Zellen auf TGN1412 verlässlich voraussagt.
Tatsächlich wurde auch an TGN1412 weitergearbeitet. Durch das verbesserte Verständnis der zugrundeliegenden Mechanismen wurde eine Dosis gefunden, die eine Überreaktion des Immunsystems vermeidet, ohne dabei die therapeutische Wirkung zu verlieren. Es gibt vielversprechende Ergebnisse aus neuen Studien an Patienten mit rheumatoider Arthritis.
Der Fall von TGN1412 hat zu verschiedenen Verbesserungen im Ablauf von Phase-1-Tests geführt, sodass das Risiko für Versuchsteilnehmer verringert werden konnte. Der Fall macht aber auch deutlich, wie wichtig Grundlagenforschung für die Medizin ist. Erst ein detailliertes und umfassendes Verständnis der physiologischen Mechanismen ermöglicht uns, geeignete Tierarten für Medikamententests auszuwählen und im Idealfall ein geeignetes tierfreies Testverfahren zu entwickeln, wie in diesem Fall geschehen.
"Das Beispiel Lipobay zeigt, dass für Tiere sichere Medikamente bei Menschen oft so starke Nebenwirkungen haben, dass sie wieder vom Markt genommen werden müssen."
Im August 2001 nahm Bayer seinen Cholesterinsenker Lipobay vom Markt. Hunderte Patienten hatten nach der Einnahme Muskelschädigungen erlitten, von denen mehrere tödlich endeten. Ist das ein Beweis, dass Tierversuche uns nicht ausreichend vor Nebenwirkungen schützen? Nein, denn ein Medikament wird niemals zugelassen, ohne auch an Menschen getestet worden zu sein.
Bevor ein neues Medikament zugelassen wird, wird es zuerst im Tierversuch auf Giftigkeit (Toxizität) getestet. Danach wird es in klinischen Studien verschiedenen Gruppen von freiwilligen Versuchspersonen verabreicht. In diesen Studien wird geprüft, ob das Medikament wie erhofft wirkt und wie häufig welche Nebenwirkungen auftreten. Nur bei guten Ergebnissen in diesen Studien wird ein Medikament zugelassen. Die Toxizitätstests an Tieren dienen also hauptsächlich dazu, die Versuchspersonen in den klinischen Tests zu schützen. Die klinischen Tests an Menschen wiederum schützen die Patienten.
Wenn bei einem Medikament nach der Markteinführung schwere Nebenwirkungen auftreten, dann sind das Nebenwirkungen, die in diesen Tests an Menschen nicht aufgefallen sind. Das kann z.B. vorkommen, wenn Nebenwirkungen so selten sind, dass sie erst in sehr großen Gruppen sichtbar werden. Schätzungen zufolge traten die Muskelschäden nach Lipobay-Einnahmen bei ca 400 von 700.000 Patienten (0.06%) in den USA auf. Zusätzlich erschwert wurde das Finden dieser schweren Nebenwirkungen dadurch, dass sie in den meisten Fällen erst bei gleichzeitiger Einnahme eines anderen Medikaments, Gemfibrozil, auftraten. Wenn wir Tierversuche heute mit weniger aussagekräftigen, tierfreien Methoden ersetzen würden, müssten wir eine höhere Anzahl von Unfällen in klinischen Tests an Versuchspersonen in Kauf nehmen, was ethisch nicht vertretbar wäre. Auf das Risiko durch selten auftretende Neben- und Wechselwirkungen, wie im Fall von Lipobay, hätte das allerdings keinen Einfluss.
"Jahrzentelange Forschung am Affen hat keinen Impfstoff und kein Heilmittel gegen AIDS gebracht."
HIV ist schwierig in den Griff zu bekommen, da es das körpereigene Immunsystem überlistet. Es ist korrekt, dass es bis jetzt keinen wirksamen Impfstoff gibt. Jedoch halfen Tierversuche in den letzten Jahrzehnten bei der Entwicklung von Medikamenten, die das Leben von Millionen Menschen verlängern und somit HIV nicht zu einem automatischen Todesurteil machen, so wie es noch in den 1980er Jahren war. Auch wurde aufgrund der Tierversuche das HI-Virus überhaupt erstmals identifiziert und neue Diagnostikmethoden entwickelt. Auch wenn die Wissenschaft im Moment nicht in der Lage ist, AIDS zu heilen, so sind und waren Tierversuche doch entscheidend für die Entwicklung von Diagnose- und Behandlungsmöglichkeiten.
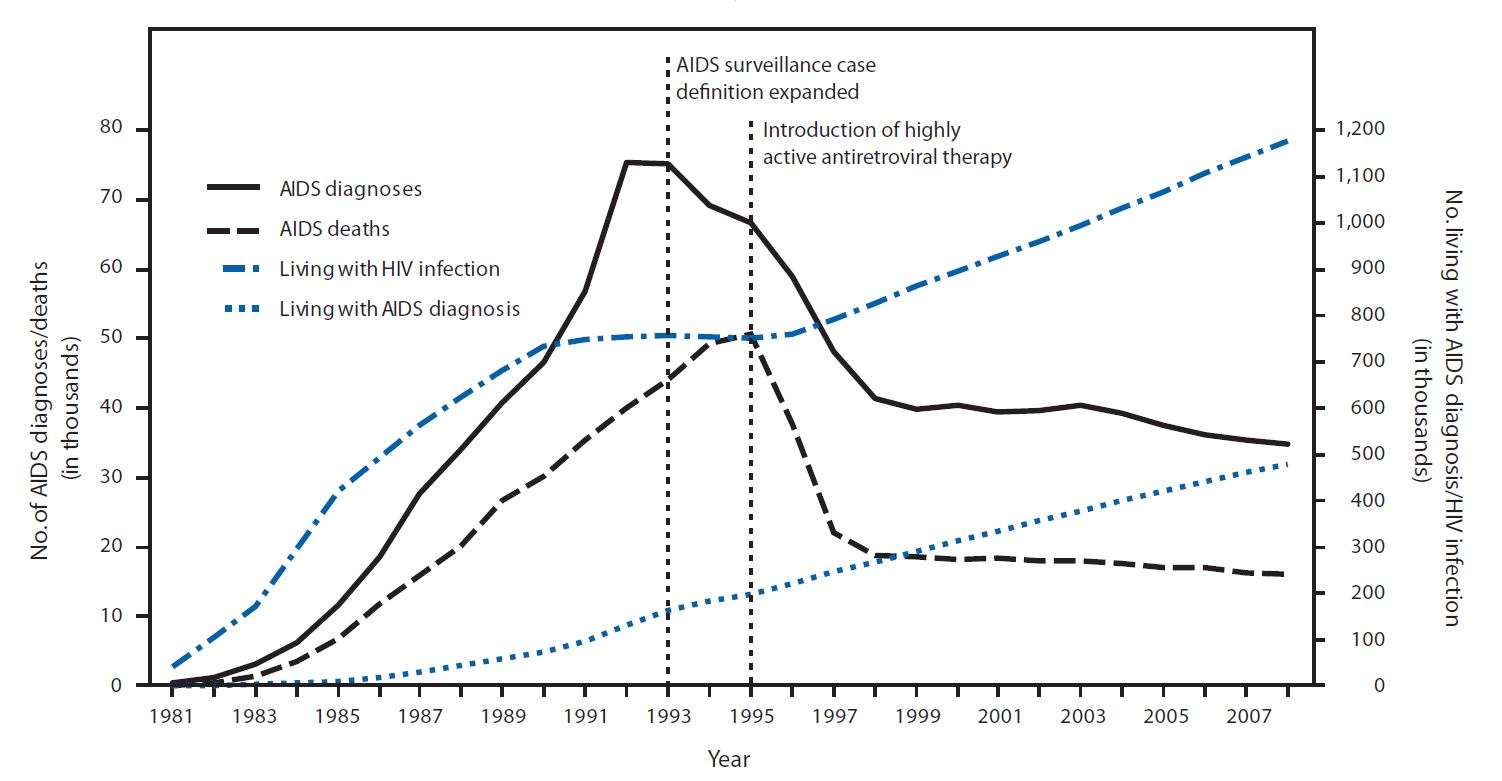
Abbildung: Diagnosen und Todesfälle durch HIV/AIDS in den USA. Mit Einführung von Proteaseinhibitoren 1995 sank die Sterberate (gestrichelte schwarze Linie) von über 50.000 auf ungefähr 18.000 pro Jahr (eine Reduktion um 64%). Quelle
"Trotz Tierversuchen haben wir immer noch kein Heilmittel gegen Krebs."
Die Lebenserwartung von Krebspatienten hat sich in den letzten Jahrzehnten stetig verbessert (siehe Abbildung unten). Nach Aussage des Deutschen Krebsforschungszentrums ist das neben besserer Früherkennung und einer gesünderen Lebensweise (z.B. Nichtraucher) auch auf die sich ständig verbessernden Behandlungsmöglichkeiten zurückzuführen. Der andauernde Erfolg bei der stetigen Verbesserung von Krebsmedikamenten wäre ohne Tierversuche nicht möglich.
Deutlich wird das am Beispiel von Brustkrebsmedikamenten. Brustkrebs ist in 8 von 10 Fällen östrogensensitiv, wird also durch das Hormon Östrogen zum Wachstum angeregt. Verstanden wurde dieses Konzept durch Forschung mit Ratten. Durch weitere Forschung mit Tieren und menschlichem Gewebe wurde der Östrogenrezeptorblocker Tamoxifen als Brustkrebsmedikament entwickelt. Die großflächige Einführung von Tamoxifen als unterstützende Therapiemaßnahme in den 1990ern reduzierte die Sterblichkeit von Brustkrebspatientinnen um ca. 30%. Hunderttausende Frauen verdanken diesem Medikament, dass sie heute leben.
Der nächste Durchbruch bei der Behandlung der Krankheit gelang mit dem Immuntherapie-Präparat Herceptin, das gegen eine besonders aggressive Art von Brustkrebs wirkt. Die Grundlage für diese Behandlung war die Entdeckung der Onkogene; das sind Gene, welche die Krebsentstehung beeinflussen. Für deren Entdeckung durch Forschung an Hühnern und anderen Tieren wurde J. Michael Bishop und Harold E. Varmus 1989 der Nobelpreis für Medizin verliehen. Auf dieser Grundlage aufbauend wurde durch Forschung mit Ratten und Mäusen gefunden, dass das Onkogen mit der Kennung „neu“ die Krebsentstehung begünstigt. Als daraufhin gezielt die Rolle dieses Gens (das in Menschen Her-2 heißt) in Krebspatienten untersucht wurde, stellte sich heraus, dass es in etwa 25% der Brustkrebspatientinnen überaktiviert ist. Es wurde die Hypothese aufgestellt, dass die Blockierung von Her-2/neu mit monoklonalen Antikörpern diese Art von Brustkrebs bekämpfen könnte. Diese Hypothese konnte in einem Mausmodell für diesen Krebs bestätigt werden. Aus diesen Studien an Mäusen entstand schließlich Herceptin, das in Europa für schwere Fälle seit 2000 und als unterstützende Therapiemaßnahme seit 2006 zugelassen ist.
Dass wir heute monoklonale Antikörper wie Herceptin überhaupt herstellen können, geht auf Grundlagenforschung, unter anderem mit Tieren, von Niels Kai Jerne, César Milstein und Georges J. F. Köhler zurück, die dafür 1984 den Nobelpreis für Medizin verliehen bekamen. Ein weiteres Beispiel für den Einsatz von Antikörpern in der Krebstherapie (Krebsimmuntherapie) findet sich im Faktencheck Tiermodelle. Herceptin gilt heute auch als wegweisend für die Entwicklung personalisierter Medizin, bei der Medikamente auf genetische Besonderheiten von Patienten maßgeschneidert sind.
Die Aussage, wir hätten kein Heilmittel gegen Krebs, geht also an der Wirklichkeit vorbei. Wir haben immer bessere Heilmittel gegen immer mehr Krebsarten – eine Entwicklung, die wir der Forschung mit Tieren verdanken.
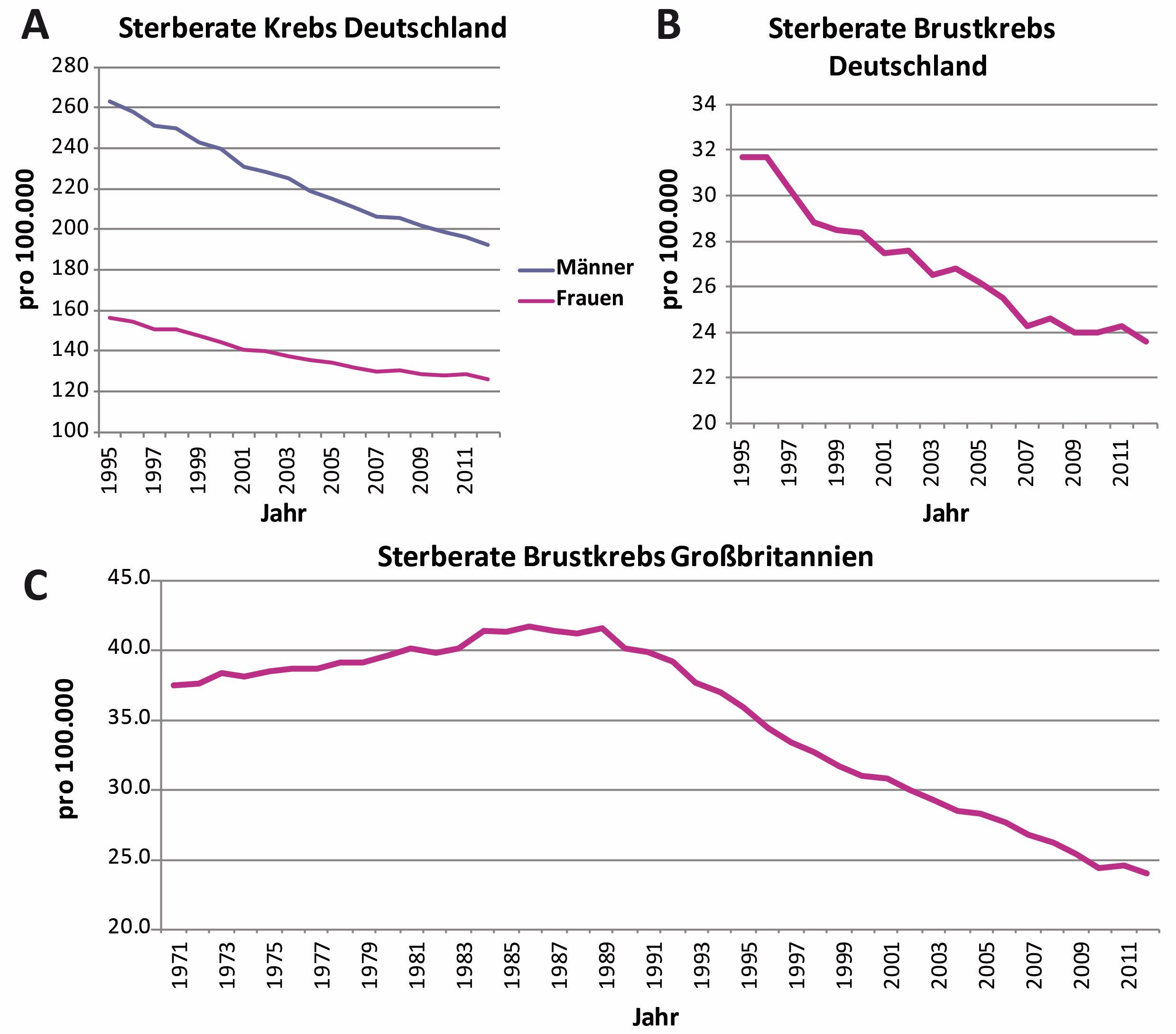
Abbildung: Sterberaten bei Krebs. Es handelt sich um nach europäischem Standard altersnormalisierte Raten. Seit 1995, dem frühesten Datum mit belastbaren deutschlandweiten Daten, geht die Sterberate für Krebs insgesamt (A) und für Brustkrebs bei Frauen (B) stetig zurück. Für Großbritannien (C), wo diese Daten seit 1971 verfügbar sind, sieht man, dass der Rückgang der Sterblichkeit bei Brustkrebs in den 1990ern eingesetzt hat. Zurückzuführen ist das neben der verbesserten Früherkennung hauptsächlich auf die Einführung von Tamoxifen als Adjuvanstherapie. Die Daten wurden abgerufen vom GEKID und von Cancer Research UK, Stand Juli 2015.
"Dass Tierversuche der falsche Weg sind, sieht man daran, dass wir Alzheimer in Mäusen heilen können, aber nicht beim Menschen."
(Stand September 2016… das aktualisieren wir bald mal! Magst Du mithelfen?)
Durch Untersuchung verstorbener Patienten wissen wir, dass sich im Hirn von Alzheimerpatienten Ablagerungen von Eiweißen finden, sogenannte Plaques. Plaques bestehen hauptsächlich aus dem Eiweiß Amyloid-beta. Um zu testen, ob Amyloid-beta die Ursache von Alzheimer sein könnte, züchtete man transgene Mäuse, die ebenfalls Amyloid-beta im Gehirn ablagern. Amyloid-beta lagert sich auch im Gehirn von Mäusen an, denen Gene eingesetzt werden, die bei Menschen eine seltenere erbliche Form der Krankheit auslösen. Alle diese Mäuse zeigen Alzheimer-artige Veränderungen, z.B. Lern- und Gedächtnisstörungen. Das unterstützt die Amyloid-Hypothese für die Entstehung von Alzheimer. Mithilfe dieser Mäuse wurden verschiedene Substanzen entwickelt, die die Entstehung von Amyloid-beta Plaques verhindern. Behandelt man die Mäuse mit diesen Substanzen, zeigen sie keine Gedächtnisstörungen mehr, sie sind, vereinfacht gesprochen, „von Alzheimer geheilt“.
Als diese Substanzen an Patienten mit fortgeschrittenem Alzheimer getestet wurden, sah man enttäuschender Weise keine Verbesserung der Symptome. Es könnte sein, dass man die Bildung von Plaques früher verhindern muss, bevor das Gehirn zu stark geschädigt ist. Es könnte auch sein, dass die Bekämpfung von Amyloid-beta schlicht nicht ausreicht, um Alzheimer zu verhindern, wie es Vertreter der Tau-Hypothese vermuten. Diesen Möglichkeiten gehen Wissenschaftler mit Hochdruck nach. In laufenden klinischen Studien wird versucht, Alzheimerpatienten das anti-Amyloid-Medikament Aducanumab in einem möglichst frühen Stadium zu verabreichen. Diese Studien zeigen äußerst vielversprechende erste Erfolge.
Es ist festzuhalten, dass die Amyloid-Hypothese aus der Untersuchung von Menschen kommt. Aber erst durch Mausmodelle konnte man die kausalen Effekte von Amyloid-beta testen. Ohne diese Experimente wüsste man bis heute nicht, ob das Eiweiß das Gedächtnis beeinträchtigt, ob es keine Rolle spielt, oder ob es vielleicht sogar Alzheimer bekämpft, also einen positiven Effekt hat. Ohne diese Mausmodelle hätte man auch keine Substanzen entwickeln können, die die Bildung von Amyloid-beta Plaques verhindern. Andere Mausmodelle werden benutzt, um die Rolle von Tau
oder entzündlichen Prozessen bei der Entstehung von Alzheimer zu untersuchen. Tiermodelle sind auch hilfreich bei der Forschung nach frühen Biomarkern – eine Grundvoraussetzung für die Entwicklung einer vorbeugenden Behandlung von Risikopatienten. Tierfreie in-vitro-Zellkultur-Modelle können helfen, zelluläre Mechanismen zu verstehen und effizientere Screenings nach möglichen Medikamenten zu machen. Sie können aber Mausmodelle nicht vollständig ersetzen. In-vitro-Zellkulturen haben z.B. kein Gedächtnis, das verloren gehen könnte. In ihnen kann man auch nicht testen, welche Rolle bestimmte Umweltfaktoren wie etwa Schlafmangel auf das Fortschreiten der Krankheit haben. Wir haben bedeutende Fortschritte im Verständnis der Krankheit und auf dem Weg zu einer besseren Behandlung gemacht. Eine Abwendung von Tierversuchen zu diesem Zeitpunkt würde den größten Teil dieser Forschung zum Stillstand bringen.
Siehe hierzu auch den Faktencheck Tiermodelle.
"9 von 10 Medikamenten, die in Tierversuchen wirken, eignen sich nicht für den Menschen. Das beweist doch, dass Ergebnisse aus Tierversuchen nicht übertragbar sind."
Bei dieser Behauptung handelt es sich um eine Verzerrung von Fakten. Hierfür muss man wissen, wie Medikamente entwickelt werden: Zuerst wird in der Grundlagenforschung (mit tierfreien Methoden und Tierversuchen) ein Punkt identifiziert, an dem ein Medikament ansetzen könnte. z.B. wie ein Krankheitserreger dem Immunsystem entkommt. Dann wird eine Substanz gefunden, die an diesem Punkt ansetzt. Als nächstes wird diese Substanz in Tieren getestet, hauptsächlich um ihre Giftigkeit auszuschließen. Wenn diese Tests keine starke Giftigkeit anzeigen, hat die Substanz die „präklinische Phase“ durchlaufen und wird an gesunden Menschen getestet (klinische Phase 1). Hier wird z.B. nach Nebenwirkungen gesucht, die in Tieren nur schwer erkennbar wären, wie z.B. Kopfschmerzen. Erst danach wird die Substanz an einer kleinen Gruppe von Patienten getestet (klinische Phase 2). Wenn sie hier erfolgversprechend ist – also die gewünschte Wirkung zeigt, aber keine nennenswerten Nebenwirkungen aufweist – wird sie an einer großen Gruppe Patienten getestet, hauptsächlich um seltenere Nebenwirkungen zu entdecken (klinische Phase 3).
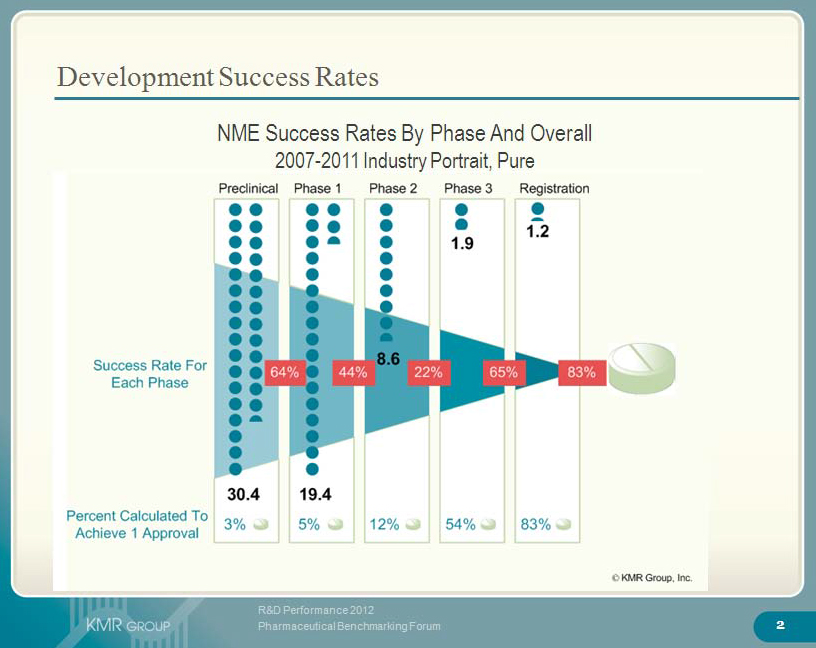
In jeder dieser Phasen der Medikamentenentwicklung werden viele Substanzen aussortiert: Entweder weil sie nicht die erhoffte Wirkung zeigen, oder wegen zu starker Nebenwirkungen. Von den Substanzen, die die präklinische Phase erfolgreich durchlaufen, werden am Ende in der Tat weniger als 1 von 10 (6%) zugelassen. Allerdings werden von den Substanzen, die durch den ersten Menschenversuch (Phase 1) kommen, auch nur etwa 1 von 7 (14%) am Ende zugelassen. Nach der Logik der Tierrechtsbewegung wäre also der Mensch ein schlechtes Modell für den Menschen.
Die Toxizitätstests an Tieren in der Medikamentenentwicklung dienen also hauptsächlich dem Schutz der gesunden Versuchspersonen in Phase 1. Menschen ungetestete experimentelle Substanzen zu verabreichen, wäre ethisch nicht vertretbar. Vielversprechende neue Methoden wie Organchips könnten die Zahl der benötigten Tiere und damit auch die Kosten von Toxizitätstests in Zukunft stark reduzieren. Bei der Findung von Ansatzpunkten für potentielle neue Medikamente, also in der Grundlagenforschung, wird auf Alternativen zu Tierversuchen zurückgegriffen, wo immer sie existieren. Dafür sorgt die Versuchstierordnung, nach der ein beantragter Tierversuch nur bewilligt wird, wenn zur Beantwortung der zugrundeliegenden Frage keine tierfreie Alternative existiert.